金纳米颗粒掺杂的羊毛角蛋白作为新型碳前体和稳定剂来制备多孔碳。在500℃碳化温度下,所得金掺杂多孔碳显示出**的脱质子化性能(pH敏感性),传感器的pH灵敏度为57 mV/pH,相对标准偏差为0.088%。在700℃碳化温度下,所得多孔碳材料具有高度sp2结构,对尿酸的氧化表现出良好的导电性和电催化活性。尿酸传感器在1–150 µM的范围内具有线性响应的特性,检测**为0.1 µM。
1.结构调控策略
在剧烈搅拌下,向5 mL羊毛角蛋白(WK)溶液(2.5wt%)中加入5 mL的HAuCl4(10×10-3 M)水溶液,调节反应物的pH至10~12,在45℃下保温12 h,得到金纳米粒子和羊毛角蛋白(AuNPs@WK)复合溶液。WK在分子水平上有利于纳米结构的调控。一方面,WK通过热处理可形成N-掺杂的芳环。另一方面,WK分子上大量的二硫键是羊毛纤维结构稳定的重要因素。在WK溶液的制备过程中,部分二硫键断裂。每一个断裂的二硫键形成两个巯基(-SH),它们不稳定但活泼,可用作还原剂。利用这些不稳定的巯基可以将Au离子还原为Au原子,并通过强相互作用使AuNPs表面吸附WK分子,使其紧密地锚定在独特的WK分子前体骨架中(图2)。将经冷冻干燥制备的固体样品在氮气气氛下于400至800℃碳化,得到AuNPs掺杂碳复合材料,命名为AuNPs@NPWC-400,AuNPs@NPWC-500,AuNPs@NPWC-600,AuNPs@NPWC-700和AuNPs@NPWC-800。
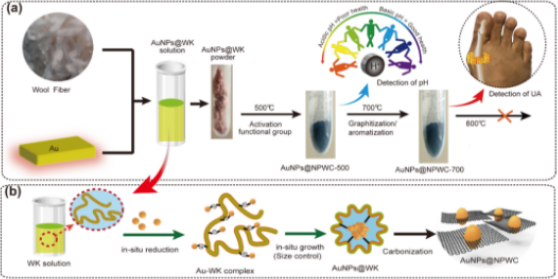
图1. 金纳米颗粒(AuNPs)掺杂多孔碳材料的制备。(a)控制制备AuNPs掺杂基于羊毛多孔碳(AuNPs@NPWC),实现不同功能与应用。在500℃碳化温度下,吡啶、吡咯等氮含量高的石墨材料对pH传感敏感,而在700℃碳化温度下,材料芳构化程度高,孔隙率高,可紧密锚定且良好分散球形AuNPs,对尿酸(UA)传感更为灵敏。(b)示意图显示了AuNPs的原位还原合成,以及**碳化成AuNPs@NPWC复合材料。
2.结构表征
孔隙度的大小取决于挥发性物质的释放。复合材料中AuNPs可催化并加速前驱体碱性蛋白质向二氧化碳和氮的演化,从而拥有高孔隙率特性和改性芳香环。图2b-f所示的TEM图像显示了AuNPs的形貌,在700℃的碳化温度下观察到尺寸范围为20-40 nm的球形AuNPs,粒径分布均匀,而在800℃时,发现了团聚颗粒。图2g-k所示为TEM图像,显示碳化温度对碳形态的影响,孔隙率和晶格百分比随温度升高而增加。在TEM成像之前,通过在乙醇中超声处理复合样品数小时,证实了AuNPs被牢固地锚定在多孔碳基体中。图2l-p为碳化样品的SEM图像显示,碳化温度从400到700℃时,复合材料的孔隙率增加,而在800℃碳化温度下,孔隙率下降。孔隙率下降是由于碳在高温软化后收缩,导致孔隙缩小或闭合。研究温度对AuNPs形貌的影响,原位合成的纳米颗粒在多孔碳微结构基体中分布均匀,活化温度从400℃增加到700℃,结构和形貌没有发生任何破坏,而在800℃下,会导致AuNPs的团聚,表面形貌破坏。X射线粉末衍射仪(XRD)图(图2q)表明了复合材料的结晶度。在2θ = 25.8°处,AuNPs@NPWC的衍射峰显示了石墨晶面(002),属于六角共轭碳结构。此外,四个较强的衍射峰对应AuNPs的(111)、(200)、(220)和(311)晶面。与粉末衍射标准联合委员会的块体金标准图比较(JCPDS:65-2870),所得AuNPs的衍射峰位于同一角度,证实了AuNPs在复合材料中的形成。碳化后的拉曼光谱证实了合成的AuNPs@NPWC的sp2和复合结构(图2r)。所有光谱都显示出两个**的谱带D和G带,D带通常归因于无序碳结构(例如纳米管壁上的缺陷、空位、扭结和杂原子),而G带则归因于C-C对称拉伸。拉曼光谱上在1360和1595 cm−1处获得的两个带是AuNPs@NPWC的D和G带。当温度从400℃升高到700℃时,ID/IG比值从0.88增加到1.01,表明碳原子SP2结构的增多。但在800℃时ID/IG下降到0.96,表明无序结构的增加。随着温度的升高,碳含量增加,氮、氢含量降低。在高于700℃的碳化温度下,C/H比几乎没有改变,表明化学成分没有进一步变化。在400、500、600、700和800℃下合成的产物的比表面积(BET)分别为27.09、381.22、452.65、625.06和447.64 m2/g。孔隙率和比表面积的稳步上升的现象,与交联反应形成的化合物有关。然而,在800℃的高温下,比表面的下降是由于碳结构的收缩。孔隙率、芳构化程度的结果与之前观察到的TEM和SEM结果一致。此外,用X射线光电子能谱(XPS)研究了碳化条件对复合材料化学状态和原子构象的影响,发现C、N、O和Au元素有四个明显的特征峰。
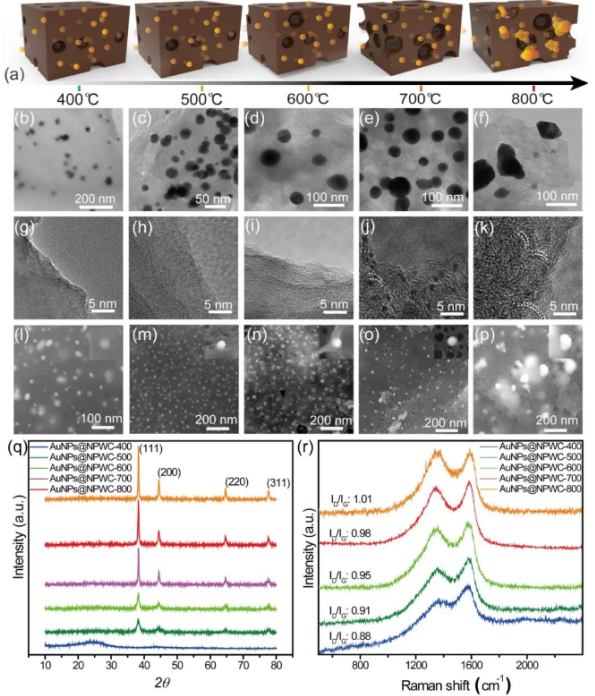
图2. 400~800℃碳化温度对AuNPs碳骨架和形貌的影响。(a)不同碳化温度下AuNPs@NPWC的结构示意图。(b-f)不同碳化温度下AuNPs@NPWC的透射电镜(TEM)图像,显示了AuNPs的形态和分散性。(g-k)TEM中显示了碳化温度对芳构化碳骨架的影响。(l-p)不同碳化温度下AuNPs@NPWC的扫描电镜(SEM)图像和AuNPs分散性情况。(q)AuNPs@NPWC的XRD图谱(r)AuNPs@NPWC的拉曼光谱。
3.pH传感
利用AuNPs@NPWC-400,AuNPs@NPWC-500,AuNPs@NPWC-600,AuNPs@NPWC-700和AuNPs@NPWC-800制备了能够检测体液pH的双电极柔性条传感器(图3a)。
具有COO-官能团的氮掺杂含碳复合材料具有芳构化碳骨架和N-掺杂结构,表现出对H+离子的高灵敏度(图3b)。研究了所制备的传感器在McIlvaine缓冲液pH在4至6之间的上升和下降响应(图3c)。其中,使用AuNPs@NPWC-500的传感器具有高灵敏度为57 mV/pH,相对标准偏差(RSD)为0.088%。我们发现复合材料的灵敏度与结构和化学性质有关。**,AuNPs@NPWC-500的表面积相当好。其次,吡啶类N1和吡咯类N2的总含量高,随着碳化温度的升高,开始转移到稳定的石墨N3和氧化N4中。高含量的吡啶N1和吡咯氮对H+更敏感。此外,C-O和C=O含量的增高,减少了以二氧化碳的生成。与无AuNPs掺杂NPWC-500的电极pH响应进行了比较,AuNPs@NPWC-500传感器的灵敏度明显较高。在没有AuNPs的情况下,碳化过程没有AuNPs的催化作用,导致孔隙率降低,使比表面积降低。综上所述,高脱质子化强烈依赖于高含量的吡啶氮和吡咯氮,以及大量的羧酸基团和良好的孔隙率,AuNPs@NPWC-500在这五种结构中具有较佳比表面积,π-共轭和N-掺杂芳香族结构组合。
对利用AuNPs@NPWC-500为工作电极条形pH传感器进行了进一步的研究。由于人体体液中的pH值通常在3到8之间,因此对基于AuNPs@NPWC-500的pH传感器在pH为3-8的范围内重复测试电位,其平均斜率为52.97 mV/pH(图3c)。当加入1mM Ca2+、1 mM NH4+、1 mM Mg2+、8 mM Mg2+、8 mM K+或20 mM Na+时,传感器对H+离子的选择性很高,电位变化为3.3%(图3d)。为了研究重现性,制作了四个平行传感器,在pH为3时绝对电位范围为373.8到377.7mV,灵敏度在每单位浓度55.2到57 mV/pH之间变化。这些传感器显示的RSD为0.88%,与先前的报告相比非常小。为了用于制备标准校准曲线和测量体液(即尿液和汗液)的pH值,对pH传感器的稳定性进行了测试,显示8小时测量中仅有0.9 mV的偏差。体液定量分析的主要障碍是Cl-对固态Ag/AgCl参比电极的影响,本文中使用基于聚乙烯醇缩丁醛酯(PVB)的Ag/AgCl参比电极克服了这一问题,这是因为PVB层含有Cl-,并且能够抵抗Cl-浓度的变化。以上测试结果表明,现有的pH传感器具有准确可靠的分析能力。
通过检测体液来研究pH传感器的实用性,使用商用pH计(M/s. Thermo-scientific)检测和验证人体汗液和尿液样本的pH值。使用传感器对体液的定量测试是通过从缓冲溶液的潜在值获得的校准曲线计算而来的。为了进行真实样本分析,收集了志愿者5份汗液和5份尿液样本。所制备pH传感器测量的汗液和尿液的pH与商用pH计所测值相比,**变化为0.72%和2.09%。这些差异与体液的正常pH值范围相比相对较小。
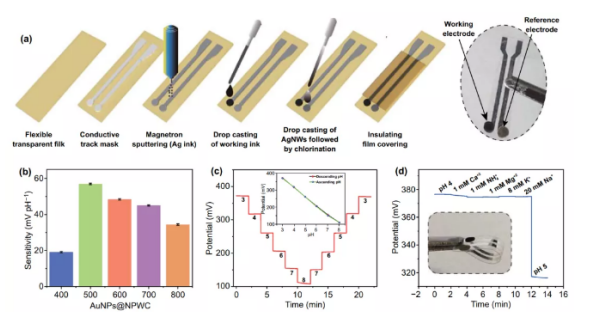
图3. pH传感器的设计和性能:(a)条状双电极柔性传感器的制备;(b)碳化复合材料传感器的pH灵敏度;(c)重复性分析;(d)AuNPs@NPWC-500传感器的选择性(插图显示传感器的弯折性能)。4. UA传感
制备了UA传感器,所得材料用于UA检测显示出高电催化活性,具有高的灵敏度和选择性。在水溶液中,UA在催化剂修饰的电极上容易被氧化释放电子。我们的非酶电催化测试表明带有金属纳米粒子的碳化材料AuNPs@NPWC由于sp2杂化碳结构和零禁带,是UA电催化氧化的较佳非酶电催化材料(图4a)。
制备了三电极柔性条基电催化系统,用于测定水介质中的UA浓度,该体系具有工作电极、Ag/AgCl参比电极和对铂电极(图5b)。**,利用在不同温度下碳化材料(AuNPs@NPWC-400,AuNPs@NPWC-500, AuNPs@NPWC-600, AuNPs@NPWC-700, AuNPs@NPWC-800)制备了五种不同工作电极的传感器。图4c为使用不同传感器在0.1 mM UA含磷酸盐缓冲液(pH = 7)中获得的伏安图。结果表明,AuNPs@NPWC-700传感器与其他相比具有较高的峰值电流。AuNPs@NPWC-700具有较高孔隙率(比表面:625.0586 m2/g)、更多的芳环化结构(图2i,p和q),以及(1d,n)良好的AuNPs分布,因此对UA的氧化表现出**的电催化性能。AuNPs@NPWC-800由于比表面减小(447.6388 m2/g)并发生AuNPs的团聚和形貌破坏(图3e和o),因此相应的传感器对UA催化氧化较慢。从所有碳化样品反卷积XPS光谱来看,C1s光谱显示C=C含量随温度升高而增加,表明石墨化程度很高,会增强电流响应。反卷积的N1s光谱显示石墨氮的百分比随温度的增加而增加,在平面上掺杂N有助于锚定AuNPs,并改善电流响应。AuNPs@NPWC-700电极在1 mM UA情况下的伏安图显示UA的氧化峰(图4d)。
微分脉冲伏安法(DPV)在-0.2~1 V的电位范围内进行,在PBS(pH = 7.0)溶液中测试出UA的氧化峰电位在0.22 V处(图4e)。峰值电流与UA浓度之间的线性响应范围为1 µM至150µM,检测限为0.1 µM(S/N = 3)。据我们所知,AuNPs@NPWC-700电极的线性范围优于先前报道的UA检测的金属纳米粒子复合碳基电极。30天后AuNPs@NPWC-700传感器氧化峰值电流值为**天的90.15%,显示出高稳定性和长期耐用性。**的稳定性归因于无电催化材料的破坏,从SEM中也可以看出电极材料在使用前后没有明显变化。在-0.25~0.75 V电压范围内,使用Ag/AgCl参比电极进行了干扰实验,筛选出可能的干扰物质:葡萄糖(0.1 mM)、抗坏血酸(0.1 mM)、尿素(0.1 mM)和乳酸(0.1 mM)。除尿酸外,其他可能的干扰物质没有记录到明显的峰,这表明所制备的AuNPs@NPWC-700电极对尿酸的选择性催化氧化性能好。
所研制的生物传感器具有较高的准确度和效率。所得条形传感器和商用UA传感器在室温下对人类尿液样本中UA浓度之间的相关曲线如图5f所示,并给出了生物传感器对UA浓度响应的校准曲线。在实际样本分析中,采取了10份来自志愿者的尿样,并用PBS(pH = 7)以1:50比例稀释。使用DPV分析每个稀释样品的电流响应,并使用校准曲线图4e(插图)计算UA的浓度。所制传感器(X轴)和商用UA检测器(Y轴)检测的UA浓度(图4f)的相关系数为0.9767。
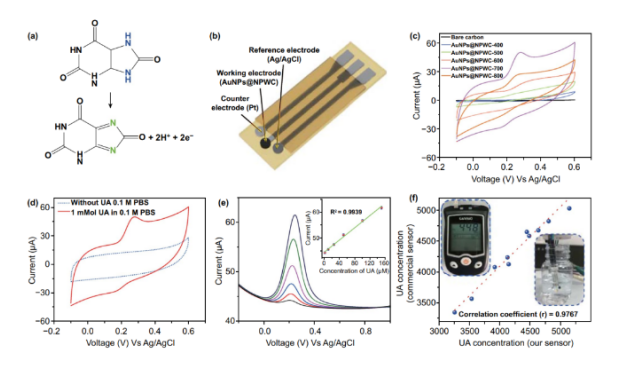
图4. UA传感器的设计和性能:(a)非酶电催化UA氧化反应。(b)条形三电极柔性传感器示意图。(c)使用不同材料电极在1.0 mM UA的PBS(0.1 M,pH=7)溶液中的循环伏安图。(d)AuNPs@NPWC-700电极在含有1.0 mM UA和不含UA的PBS(0.1M,pH=7)溶液中的循环伏安图。(e)AuNPs@NPWC-700电极在不同浓度的UA(1–150 µM)的PBS(0. 1M pH=7)溶液中的差示脉冲伏安(DPV)曲线。相应氧化电流与UA浓度的关系图(插图)。(f)所研制的生物传感器与商业标准UA计的性能相关性。
我们有零维/一维/二维/三维四个分类来提供几十个产品分类和几千种纳米材料,材料的材质包含金属纳米材料和非金属纳米材料以及他们的氧化物或碳化物及复合定制等等,粒径从5纳米-2000纳米均可选择。
相关产品
离子液体包裹纳米金修饰
碳包裹纳米金属粒子
高分子脂质体包裹的纳米金(LADL@Au NPs)
介孔二氧化硅包裹的正电荷纳米金
聚乙烯亚胺/聚乙二醇修饰纳米金颗粒
负载钆钆螯合剂DOTA-NHS的树状大分子包裹的纳米金颗粒
环糊精修饰的树状大分子包裹的纳米金
聚乙二醇化树状大分子包裹的纳米金颗粒
RGD多肽修饰的多功能树状大分子包裹的纳米金颗粒
透明质酸包裹的金纳米粒子
壳聚糖包裹纳米金粒子
泛影酸/叶酸修饰的多功能树状大分子包裹的纳米金颗粒Au DENPs
靶向脂质体包裹水相纳米金复合物
壳聚糖改性聚氨酯及壳聚糖包裹纳米金
叶酸修饰的多功能靶向造影剂磁性氧化铁/金纳米颗粒
叶酸修饰的复合泛影酸的聚酰胺-胺树状大分子金纳米粒子
柠檬酸根包裹的纳米金颗粒
金纳米颗粒功能化二硫化钼纳米复合材料
溶菌酶功能化金纳米颗粒材料
鲁米诺及衍生物功能化的金纳米材料
DNA功能化的金纳米颗粒
苝酰亚胺功能化的金/银纳米颗粒
杯芳烃功能化金纳米颗粒
赖氨酸修饰的苝酰亚胺功能化金纳米颗粒
多层壳包覆的功能化金纳米颗粒
乳糖酸修饰的低代数PAMAM包裹金纳米颗粒
硫辛酸功能化的金纳米颗粒
树枝化聚苯/金复合纳米粒子
功能化Pd@Au纳米颗粒
抗氧化配基功能化的金纳米复合物
功能化金刚石纳米颗粒
多肽功能化金纳米颗粒
纳米金颗粒包裹的PEG功能化PAMAM树状大分子
金纳米颗粒修饰的硫酚功能化石墨烯复合材料
叶酸修饰的多功能靶向造影剂磁性氧化铁/金复合纳米颗粒
三联吡啶衍生物配体与β-二酮稀土配合物包覆金纳米颗粒
金纳米颗粒修饰的多壁碳纳米管(MWCNTs)
多官能团表面修饰金属纳米颗粒
碳纳米管/聚苯胺/纳米金复合材料
配位键修饰的功能性纳米颗粒/氧化石墨烯纳米杂化材料
牛血清白蛋白修饰纳米金颗粒
金纳米颗粒功能化还原氧化石墨烯(RGO)和多壁碳纳米管(MWCNTs)
铂修饰的枝状金纳米复合材料
C18键合纳米金修饰二氧化硅颗粒
石墨烯(GS)-壳聚糖(CS)-纳米金(Nano-Au)复合材料
纳米金(Au)包被瘦肉精-牛血清蛋白(CLB-BSA)
纳米金修饰羧甲基壳聚糖
纳米金修饰乙酰胆碱酯酶
柔红霉素修饰的纳米金
金纳米颗粒复合材料(ssDNA-AuNPs);Hyaluronic Acid-DNA透明质酸修饰脱氧核糖核酸
二氧化硅包裹金纳米颗粒
氨基、羧基功能化的纳米金试剂
PEG包裹的纳米金颗粒(PEG末端链接不同基团)
BSA包裹的纳米金颗粒
葡聚糖包裹的纳米金颗粒
氨基功能化的金纳米粒子
羧基功能化的金纳米粒子
聚乙烯亚胺包裹纳米金(PEI-nanogold)
氧化气氛下氧化钛包裹金纳米颗粒
金纳米离子包裹二氧化硅壳核材料
红细胞膜包被金纳米颗粒
11-巯基十一烷酸包裹的金纳米颗粒
单分散性PEG修饰金纳米颗粒
纳米金颗粒标记外泌体
葡萄糖包被的纳米金颗粒(Gold Nanoparticle, GNP)
纳米金颗粒标记外泌体
氧化硅修饰的纳米金
D-丙氨酰-D-丙氨酸(D-alanyl-D-alanine,DADA)修饰金纳米颗粒(Au_DADA)复合材料
四面体DNA修饰金纳米颗粒上合成Au-TDNNs复合材料
精氨酸/氨基酸修饰金纳米颗粒
富勒醇修饰的金纳米颗粒
肽修饰的金纳米颗粒
FITC/羧基官能化修饰金纳米颗粒
CY3/FITC/马来酰亚胺功能化金纳米颗粒
CY3和羧基官能化金纳米颗粒
FITC和叠氮功能化金纳米颗粒
Cy3和NHS功能化金纳米颗粒
FITC和甲基功能化金纳米颗粒
FITC和生物素功能化金纳米颗粒
Cy3和蛋白A功能化金纳米颗粒
zzj 2021.3.17




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询