萤火虫荧光素酶是一个61kDa单亚基蛋白质,酶活性不需翻译后修饰(3,4)。因此,一旦翻译完成即具有遗传报告基因的功能。在ATP,Mg和 O存在下,通过甲虫荧光素的氧化反应放出光子(图1)。在传统反应条件下,荧光素的氧化要经过一个荧光素-AMP中间体,转换非常缓慢。结果,这种检测化学在底物和酶混合后产生一种"闪烁"光,并迅速衰减。现在,普洛麦格公司在获得专利的定量检测萤火虫荧光素酶活性的试剂中加入了辅酶A(CoA),通过加快酶转换(5)提供改进的反应动力学,从而得到延长的"辉光"荧光信号(图2)。
海肾荧光素酶是一个36 kDa单亚基蛋白质,纯化自自然界来源的Renilla reniformis"%) ,含有3%的碳水化合物。如同萤火虫荧光素酶,海肾荧光素酶的活性也不需要翻译后修饰,一旦翻译完成即可行使遗传报告基因的功能。海肾荧光素酶利用Oz和腔肠荧光素(coelenterazine)催化发光反应(图1)。当应用DLR检测化学操作时,海肾荧光素酶的反应动力学产生辉光型荧光信号,并在测量过程中缓慢地衰减(图2)。
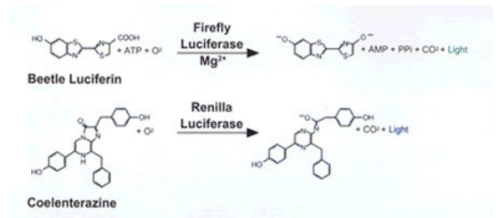
图1.由萤火虫和海肾荧光素酶所催化的生物发光反应
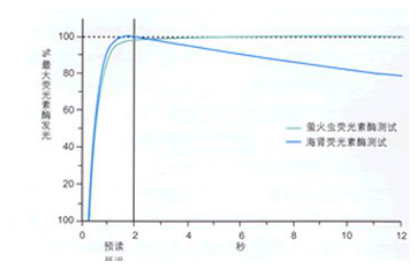
图⒉用双荧光素酶报告基因检测试剂盒检测到的萤火虫和海肾荧光素酶产生的荧光。
在DLR检测系统中,萤火虫和海肾荧光素酶的活性是从同一裂解液中分步测量的。在完成萤火虫荧光素酶活性("实验"报告基因)的测量后,萤火虫荧光被快速淬灭,并在这同时激活海肾荧光素酶的荧光反应("对照”报告基因的活性)。因此,DLR检测系统综合了两个检测化学,对来自转染细胞裂解液或无细胞转录/翻译反应中共同表达的两个报告基因快速地提供定量结果。
萤火虫荧光素酶检测的线性范围延伸达酶浓度的8个数量级,可检测≤lfg(大约10摩尔)的实验报告基因酶(图3A)。用双荧光素酶报告基因检测系统,海肾荧光素酶的线性范围达酶浓度的7个数量级,对照报告基因酶检测的底限≤10fg(大约3×101摩尔)(图3B)。此外,这两个酶表现的特异性活性相似。
用pGL3 -Control和pRL-SV40载体DNA共同转染CHO细胞(1×10°个细胞/60mm培养).细胞用PBS洗涤后,加入400ul的 PLB并刮下细胞,制成裂解液。分出 20ul 的细胞裂解液,并将其和100ul的荧光素酶检测试剂II(LARII)混合,立即用荧光发光计测量萤火虫荧光素酶的活性(绿线)。然后,在荧光发光计试管中加入100ul的 Stop &GloTM试剂,以淬灭萤火虫荧光素酶反应,同时激活海肾荧光素酶反应,并立即测量海肾荧光素酶的活性(蓝线)。此实验使用Turner Designs型号20e荧光发光计,配合一台计算机来示踪在12秒钟检测时间段内的荧光发射情况。
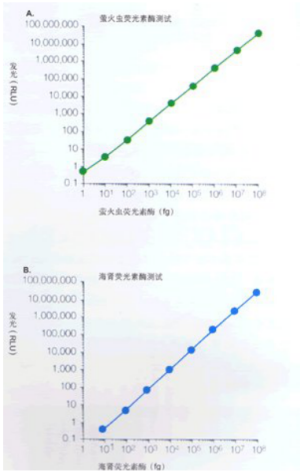
图3.萤火虫荧光素酶和海肾荧光素酶发光反应的线性范围。
纯化的萤火虫和海肾荧光素酶经含有1mg/ml BSA的1xPLB缓冲液连续稀释。使用配有计算机的Turner Designs 荧光发光计20e型,在经过一个初始2秒的预读延迟后,确定两种荧光素酶在各种不同浓度时,在10秒钟内的总荧光。
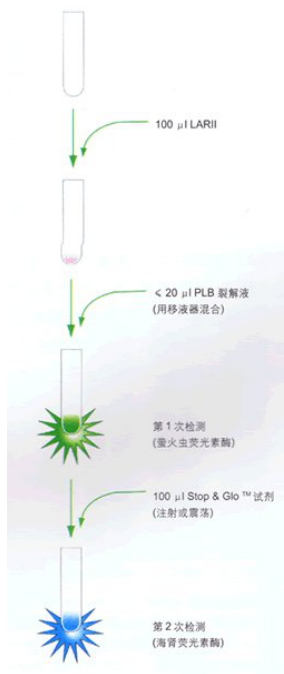
图4.用手动操作的荧光发光计,或配有一支试剂进样器的荧光发光计进行双荧光素酶检测的方法。
如果荧光发光计配有两个进样器,则将裂解的样品预先分装到荧光发光计的试管中,随后按次序自动加入LuciferaseAssay Reagent II(LAR I)和 Stop & GloTM试剂。
相关产品提供
D2R
BZiPAR
BZAR
Ac-IETD-R110
Ac-DEVD-AMC
2',7'-二氯荧光素二乙酸酯
Dihydrorhodamine 123, dihydrochloride salt
二氢若丹明123
二氢乙锭
CF640R Tyramide
CF594 Tyramide
CF568 Tyramide
CF543 Tyramide
CF488A Tyramide
CF350 Tyramide
Biotin-XX Tyramide
2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐
10-Acetyl-3,7-dihydroxyphenoxazine
氯化硝基四氮唑兰
4-甲基伞形酮磷酸二钠盐三水
MUP, free acid
1, 6-二磷酸果糖钠
Chromogenic Phosphatase Substrate Sampler
5-溴-4-氯-3-吲哚基磷酸酯对甲苯胺盐
BCIP Red
BCIP Pink
XTT 钠盐
Resorufin (high purity)
Resazurin, Sodium Salt
噻唑蓝
2,3-二(4-甲基苯基)-1H-四唑-3-鎓-5-甲腈氯化物
zl 02.22




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询